1․ 5֊րդ խմբի գլխավոր. ենթախմբի տարրերի ընդհանուր բնութագիրը։
5֊րդ խմբի գլխավոր. ենթախմբի տարրերն են ազոտը N, ֆոսֆորը P, արսենը As, անտիմոնը Sb, բիսմուտը Bi, որոնց ատոմների հատկությունները իրար նման են։ Դրանք բոլորն էլ P տարրեր են, արտաքին էլեկտրոնային թաղանթում ունեն հնգական Էլեկտրոն։
2․ Ազոտ և ֆոսֆոր տարրերի ատոմների կառուցվածքը։
Ազոտ (լատ.՝ Nitrogenium – ածուխ ծնող), քիմիական տարր, պարբերական աղյուսակի 5-րդ խմբի 7–րդ տարրը, քիմիական նշանը՝ N, ատոմային թիվը՝ 7, ատոմային զանգվածը՝ 14.0067: Ազատ վիճակում անհամ և անհոտ գազ է, ջրում վատ է լուծվում։ Մոլեկուլը կազմված է 2 ազոտի ատոմներից (N2), որոնց կապը շատ ամուր է։ Բնության մեջ ազոտը կազմված է 14N (խառնուրդում բաղադրությունը՝ 99.63%) և 15N կայուն նուկլիդներից։ Արտաքին էլեկտրոնային մակերեսի կարգը 2s²2p³: Ազոտի նեյտրալ ատոմի շառավիղը 0.074 նմ է, իոններինը. N3- – 0.132, N3+ – 0.030 և N5+ – 0.027 նմ։ Պարզ նյութ ազոտը (CAS-համարը 7727-37-9) բավականին իներտ գազ է, որը կազմում է երկիր մոլորակի մեկ քառորդը։
Ֆոսֆոր (լատ.՝ Phoatsphorus ), քիմիական տարր, որի նշանն է P։ Գտնվում է տարրերի պարբերական համակարգի 3-րդ պարբերության 5-րդ խմբի տարր։ Կարգահամարը՝ 15, ատոմական զանգվածը՝ 30,97376։ p տարր է, ատոմի արտաքին էլեկտրոնային թաղանթների կառուցվածքն է՝ 3s2Зр3, К և Լ թաղանթները լրացված են։ Բնական ֆոսֆորը բաղկացած է միայն 31Р կայուն իզոտոպից։
3․ Ազոտ. ազոտի օքսիդները. ազոտական թթուն և նրա աղերը։
Ազոտի օքսիդներ, անօրգանական միացություններ են, ազոտի և թթվածնի միացությամբ։ Թթվածնի հետ ազոտն առաջացնում է 6 կայուն միացություն։ Ազոտի բոլոր օքսիդները սովորական պայմաններում գազեր են բացի N2O5 անգույն բյուրեղական նյութ է։
Բարձր ջերմաստիճանում առաջացնում է ազոտ և թթվածին։ Բարձր կոնցենտրացիայի դեպքում N2O ազդում է նյարդային համակարգի վրա («ուրախացնող գազ»)։ Բժշկության մեջ օգտագործում են N2O, որպես թույլ անզգայացնող միջոց։ N2O անվանում են նաև ազոտային օքսիդ։ Ազոտային օքսիդը երբեմն օգտագործում են ներքին այրման շարժիչների բարելավամ և տաքացման համար։
Ազոտի օքսիդը NO (ազոտի մոնօքսիդ), անգույն գազ է, ջրում քիչ լուծվող։ Չի փոխազդում ջրի, թթուների, ալկալիների հետ։ Ազոտի (II) օքսիդը միացություններում շատ ռեակցունակ է, կարող է ռեակցիայի մեջ մտնել մի շարք աղերի, հալոգենների, օրգանական միացությունների հետ։ Սովարական ջերմաստիճանում NO փոխազդում է թթվածնի հետ առաջացնելով NO2։ NO օքսիդը ստանում են ամոնիակի կատալիտիկ օքսիդացումով, ազոտական թթվի արտադրությունում։
N2O3 օքսիդը (ազոտի անհիդրիդ), մուգ կապույտ հեղուկ է, փոխազդում է ջրի հետ առաջացնելով ազոտային թթու HNO2։
NO2 ազոտի օքսիդը (ազոտի երկօքսիդ), գորշ, թունավոր, օդից ծանր, հեշտ հեղուկացող գազ է։ Սենյակային ջերմաստիճանում NO2 խառնուրդը խառնվում է անգույն դիմերի N2O4 հետ, մոտավորապես 1։1 հարաբերությամբ։ Փոխազդում է ջրի հետ.

և նատրիումի հիդրօքսիդի հետ.
Ուժեղ օքսիդիչ է։ Շատ նյութեր (ածուխ, ծծումբ, ֆոսֆոր, օրգանական միացություններ) կարող են այրվել NO2 օքսիդում։ Այս օքսիդը օքսիդացնում է SO2 օքսիդը մինչև SO3 օքսիդի, այս ռեակցիայի արդյունքում ստացվում է ծծմբային թթու։ Այս օքսիդը կարող է նյարդայնացնել շնչառական ուղիները, իսկ բարձր կոնցենտրացիայի դեպքում առաջանում է թոքային էմբոլյա։
N2O5 ազոտի օքսիդը, անգույն, բյուրեղային պինդ նյութ է, հեշտությամբ կարող է փոխազդում է NO2 և О2 նյութերի հետ։ Ուժեղ օքսիդացնող է։ Ջրում հեշտությամբ լուծվում է առաջանելով ազոտական թթու․
Ազոտական թթու, քիմիական բանաձևն է (HNO3), խոնավ օդում ծխացող նյութ է, ուժեղ միահիմն թթու և շատ ուժեղ օքսիդիչ, մանավանդ խիտ լուծույթներում հանդես է գալիս գլխավորապես որպես օքսիդիչ: Խիտ ազոտական թթուն ունի երկու տարաձևություն՝ մոնոկլինային և ռոմբիկ բյուրեղացանցով։ Ջրի հետ խառնվում է ցանկացած հարաբերությամբ։ Ջրային միջավայրում համարյա ամբողջությամբ դիսոցվում է իոնների: Ջրի հետ փոխազդում է 68,4% և 120 °C ջերմաստիճանային պայմաններում և մթնոլորտային ճնշման տակ։ Հայտնի են երկու բյուրեղահիդրատներ՝ մոնոհիդրատ (HNO3·H2O Tհլ = −37, 62 °C) և եռհիդրատ (HNO3·3H2O Tհլ = −18, 47 °C)։Ազոտական թթվում ազոտը քառավալենտ է՝ +5 օքսիդացման աստիճանով։ Պնդանում է −41, 59 °C, եռում `+82, 6 °C: Ուժեղ ազոտական թթուն ձևավորում է 2 բյուրեղավանդակներ. բազմանկյան տարածական ձև՝ P 21/a, a = 1, 623 նմ, b = 0, 857 նմ, c = 0, 631, β = 90°, Z = 16; շեղանկյան տարածական ձև
Ազոտական թթվի աղերը՝ նիտրատներըԱզոտական թթվի բոլոր աղերն առանց բացառության ջրում լուծելի, բյուրեղային նյութեր են, ենթարկվում են ջերմային քայքայման՝ ըստ հետևյալ ուրվագրի՝
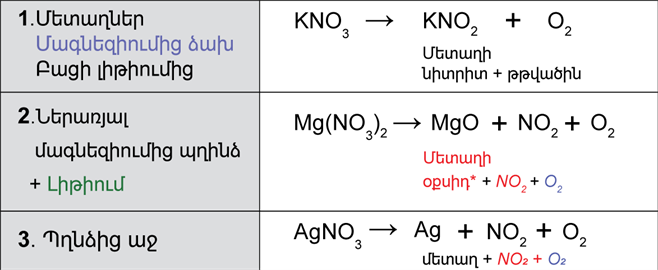
4․ Ֆոսֆորի պարզ նյութերը` կարմիր և սպիտակ ֆոսֆոր։ Օրթոֆոսֆորական թթուն և նրա աղեը։

Տարրական ֆոսֆորն ստանում են կալցիումի ֆոսֆատի, սիլիկահողի և ածխածնի խառնուրդն էլեկտրական վառարանում առանց օդի մուտքի մինչև 1600 °C տաքացնելով՝
Ստացված գազային P4-ը բաց թողնելով ջրի մեջ՝ վեր են ածում պինդ վիճակի։ Ֆոսֆորի գոլորշիները փոշեզրկելուց հետո սառեցնում են (50 °C) և ստացվող տեխնիկական սպիտակ ֆոսֆորը հավաքում ջրի տակ։Սպիտակ ֆոսֆորը ճնշման տակ (մոտ 15 000 մթնոլորտ) տաքացնելիս՝ 200-220 °C, փոխարկվում է սև ֆոսֆորի (նման է գրաֆիտին, կիսահաղորդիչ է)։
Ֆոսֆորը հիմնականում օգտագործվում է ֆոսֆորական թթու և նրանից ֆոսֆորական պարարտանյութեր և այլ ֆոսֆատներ ստանալու համար։
Հալման ջերմաստիճանը 44,1 °C, եռմանը՝ 280,5 °C, խտությունը՝ 1828 կգ/մ3։ Օդում (40 °C-ում) ինքնաբռնկվում է (պահում են ջրի տակ)։ Բաղկացած է Р4 մոլեկուլներից (Ֆոսֆորի մյուս ձևափոխություններն ատոմական պոլիմերներ են)։ Տաքացնելիս 250-300 °C դանդաղ փոխարկվում է կարմիր ֆոսֆորի։ Այն առաջացնում է բյուրեղական մի քանի ձևափոխություններ, որոնք 416-423 °C-ում սուբլիմվում են և ունեն 2000-2400 կգ/մ3 խտություն։
Քիմիապես ավելի պասսիվ է, օդում բռնկվում է 240-250 °C տաքացնելիս, համարյա թունավոր չէ։ Չի լուծվում ջրում և ծծմբածխածնում։ Ապրանքային կարմիր ֆոսֆորը գործնականորեն ամորֆ է, գույնը՝ կարմրաշագանակագույնից մանուշակագույն։
Ֆոսֆորական թթու ֆոսֆորական (օրթոֆոսֆորական) թթուն՝ H3PO4, ջրում լավ լուծվող, սպիտակ պինդ նյութ է։ Արդյունաբերական պայմաններում ֆոսֆորական թթուն ստանում են՝ ֆոսֆորային հանքը տաքացնելով խիտ ծծմբական թթվի հետ կամ ֆոսֆորի օքսիդը ջրում լուծելով։ Միջին ուժի, եռհիմն թթու է, կարող է առաջացնել երկհիդրոֆոսֆատ, հիդրոֆոսֆատ և ֆոսֆատ անիոններ և հետևաբար՝ 3 խումբ աղեր։ Եթե մետաղի ատոմները նշանակենք Me-ով, ապա նրա աղերի բաղադրությունը
Օրթոֆոսֆորական թթվի անհիդրիդը ֆոսֆորի օքսիդն է՝ P2O5, որն օժտված է թթվային օքսիդների բոլոր հատկություններով, մասնավորապես փոխազդում է հիմնային օքսիդների և հիմքերի հետ։ Եթե կազմելու լինենք P2O5-ի հետ 
5․ Ազոտական և ֆոսֆորական պարարտանյութեր։
Այն նյութերը, որոնք պարունակում են մ3 կարևորագույն սննդարար տարրեր N P K և ընդունակ են հողային լուծույթում դիսոցվելու իոնների, օգտագործվում են որպես հանքային պարարտանյութեր։
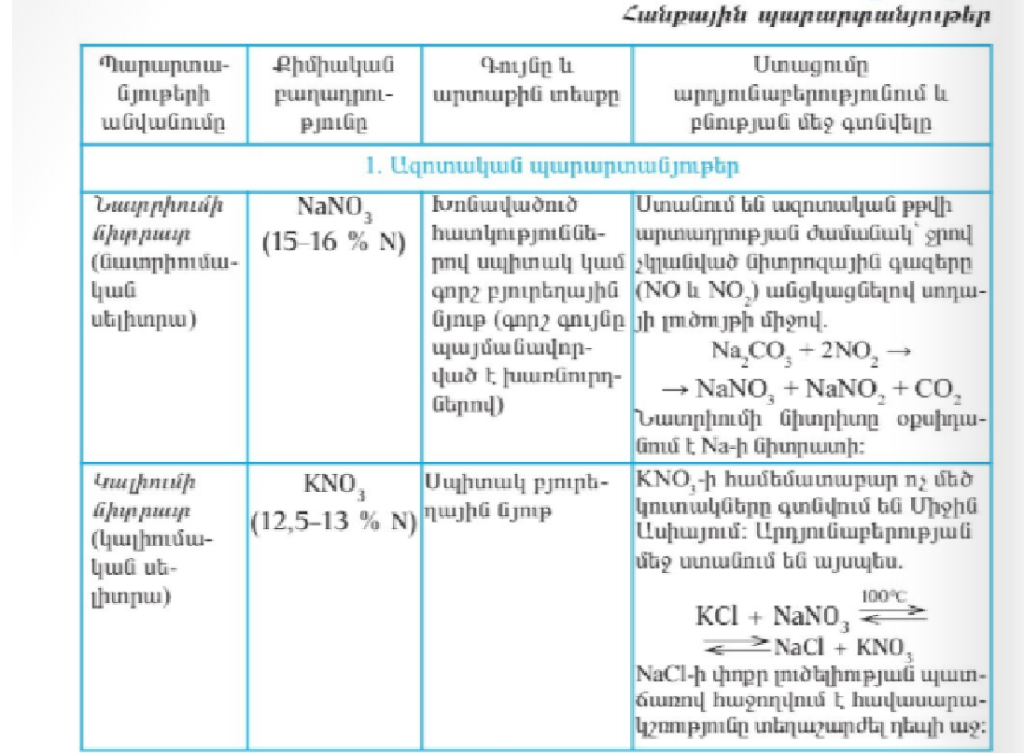
Ազոտական պարարտանյութեր են Նատրիումի նիտրատը /նատրիումական սիլիտրան/ NaNO3 /15-16%/ , այն խոնավածուծ հատկություններով սպիտակ կամ գորշ բյուրեղային նյութ է։ Ստանում են ազոտական թթվի արտադրության ժամանակ ջրով չկլանված նիտրոզային գազերը NO2 NO անցկացնելով սոդայի լուծույթի միջով․

*»Ընտանեկան դպրոցի» հարցեր.
1. Ի՞նչ. պայմաններ են անհրաժեշտ բույսերի. աճման համար… Բույսերի աճման համար անհրաժեշտ է ջերմություն, լուսավորություն, խոնավություն, տվյալ բույսի համար նախատեսված կլիմայական պայմաններ և պարարտ հող։Անհրաժեշտ է մոտ 22 քիմիական տարր, կարևոր է կալիում, ածխախին, ազոտ, ֆոսֆոր , թթվածին և ջրային տարրերի նշանակությունը։
2. Ինչո՞ւ են ազոտը և ֆոսֆորը համարվում կենսական տարրեր.
Ազոտը և ֆոսֆորը համարվում կենսական տարրեր քանի որ երկիր մոլորակի մեկ քառորդը կազմված է ազոտից ։ Ֆոսֆորը մտնում է բույսերի գլխավոր օրգաններում , կենդանիների և մարդու նյարդային և ոսկրային հյուսվածքներում գտնվող մի շարք սպիտակուցային նյութերի բաղադրության մեջ։ Ֆոսֆորով առանձնապես հարուստ են ուղեղի բջիջները։
3. Ինչո՞ւ են հողին տալիս պարարտանյութեր
Հողին տալիս են պարարտանյութեր, որպեսզի այն հարստացնեն օգտակար հանքանյութերով և ստանան ավելի առատ և փարթամ բույսեր /մրգեր, հատապտուղներ, բանջարեղեն, հացահատիկային մշակաբույսեր և այլն/
4. Ի՞նչ է «Նիտրատային աղետը «
1970-ական թվականներին աշխարհի տարբեր երկրներում հանելուկային թունավորումների բռնկումներ գրանցվեցին: Ինչպես պարզվեց՝ պատճառը նիտրատներն էին, որոնք մեծ քանակությամբ օգտագործվել էին, որպես պարարտանյութ: Ահա՛ թե ինչու նիտրատներ պարունակող սննդամթերքներով զանգվածային թունավորումներ անվանվեցին նիտրատային աղետ:
Նախկինում, երբ որպես պարարտանյութ օգտագործում էին գոմաղբը, նիտրատների հիմնախնդիր չի առաջացել: Գոմաղբմ ու օրգանական բնույթի մյուս պարարտանյութերը դանդաղ քայքայվում են՝ ապահովելով ազոտի մուտքը դեպի բույսեր, և հողում նիտրատների ավելցուկ չի առաջացնում:
Մինչդեռ միլինավոր տոննաներով արտադրվող հանքային պարարտանյութերի չափից ավելի մեծ քանակությամ դեպքում բույսերը ցողուններում, տերևներում և պտուղներում նիտրատներ են կուտակու: Բացի այդ՝ ազոտի միացությունների ավելցուկը հողի մակերեսային շերտից ջրով անցնում է խորքային ջրերի մեջ, այնուհետև՝ խմելու ջրի հետ թափանցում մեր բնակարանները:
Ջրի կամ սննդամթերքի հետ մարդու օրգանիզմ թափանցելով՝ նիտրատները փոխարկվում են նիտրատների, որոնք ավելի վտանգավոր միացություններ են, քանի որ փոխազդում են արյան հեմոգլոբինի հետ: Որպես արդյունք՝ արյան կարմիր բջիջները էրիտրոցիտները, կորցնուկ են թոքերից դեպի հյուսվածքները:



